单细胞技术正在成为生物分析中越来越重要的工具。作为对大量细胞群体的平均测量的补充,单细胞测量提供了复杂生物学的更精细的图像,并揭示了组织中存在的异质性。随着微流体学、电生理学测量、高分辨率成像、深度测序和质谱平台的日益成熟,细胞亚型、组织中的物理位置和克隆进化的更详细图像正在出现。
近年来,越来越多的单细胞技术被开发出来,如单细胞表面功能化、细胞内电生理、单细胞分离、单细胞测序等。虽然单细胞测序是最广泛使用和众所周知的,但它的发展离不开其他单细胞技术,如单细胞分离。因此,单细胞技术不应该只聚焦在单细胞测序中,细胞异质性的研究将是一个长期的系统工程,目前主要在科学研究中大力应用去奠定know-how基础,在社会经济影响上是缓慢且螺旋上升的。而其他细胞操控基本工具,比如单细胞表征、操控、分选以及单克隆形成等,在加快细胞与基因治疗(CGT)药物研发效率方面的作用是显而易见的,也正在彻底改变现代药物研发公司的药物发现和开发进程。
但是,在高通量单细胞表征、无标记单细胞分选和单细胞操控技术上还有很多可以提升的空间,本文就盘点了数家在这些领域内极具创新精神的单细胞公司。
1,Berkeleylight

一句话亮点:基于光电定位OEP技术的单细胞操控平台
BerkeleyLights(BLI)创立于2011年,总部位于美国加州Emeryville,于2020年在Nasdaq上市。其纳米光导流体平台OptofluidicPlatform是结合纳升级微流控反应器技术(Nano-Pen)和光电定位技术(OEP)完成单细胞分选、分析、培养以及导出功能的多功能单细胞平台。在BLI平台承载微流控体系的是其核心OptoSelect芯片。该芯片是一个精细的、集约化的、细胞运输和培养功能兼而有之的流体管路系统,由纳升级培养小室Nano-Pen和微流管道构成。微流系统可实现单细胞的运输,而通过加以特殊外力即可实现向Nano-Pen中分选入单细胞;这种特殊外力作用便是OEP技术。
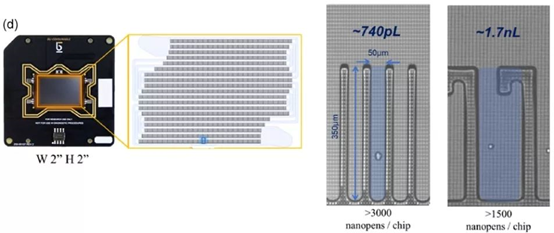
OptoSelect芯片的构造及Nano-Pen形状大小
OEP的前身是2018年诺贝尔物理学奖获得者之一的Ashkin发明的OpticalTweezer光镊技术,其原理是利用单个激光束通过高倍的显微物镜聚焦形成光阱,微观粒子受光压而束缚在光阱处,使用皮牛级别的力操纵和移动陷入光阱的微观粒子。但是这项技术在需要较高强度的激光强度,会损坏细胞,且难以同时操作多个细胞。为了克服这些局限,开发了新的光电定位技术OEP,利用光束同时在光敏感材料上产生电势场,它能够同时并且大量的操控单细胞,并且OEP允许较低的光源能量,可以在更大的处理面积进行实验。这一技术需要光学器件和配套的芯片组件的结合来完成,如下图所示:
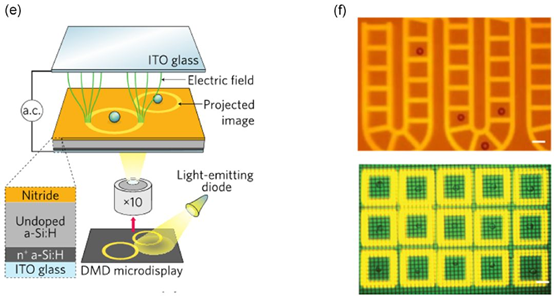
BLIOptofluidicPlatform中所使用的OEP技术原理
整个OEP部件由光学系统和光敏感材料组成。光源经过透镜选择性地照射到目标位置。入射光在基于氢化硅的光导电极作用下,在照射部位的上方空间产生局部的电场,产生电场力。通过调整入射光的位置,推动该位置的颗粒(如细胞)移动。这种光电定位OEP技术配合微孔外的微流,即可实现不依赖于荧光染料标记的活细胞定向分选和收集到纳升级培养小室Nano-Pen中。
BLI技术平台的运用,能够从技术层面明显缩短整个项目开发所需要的时间,同时平台所实现的整合、集约化和可实时监控的工作流程使得研发工作变得紧凑而高效,更加便于制药企业以及CRO或者研究单位的项目管理。目前BLI的单细胞光导流体平台具体应用的领域包括抗体发现、细胞克隆筛选、细胞系构建、细胞治疗研究等,具有广阔的应用前景。
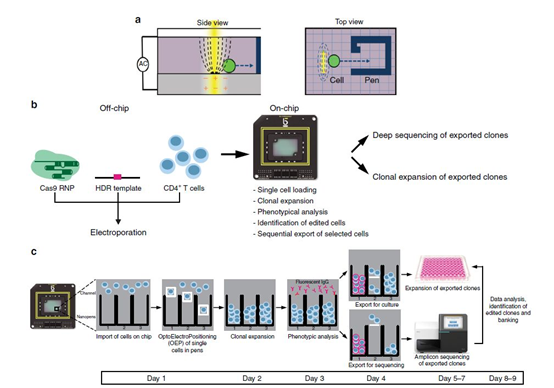
BLI单细胞技术快速评估基因编辑T细胞表型
2,IOTAScience

一句话亮点:纳升级网格式单细胞克隆技术
IotaSciences是牛津大学(英国)孵化的公司,于2016年创立,致力于为研究人员提供可靠且功能强大的单细胞处理技术和解决方案。
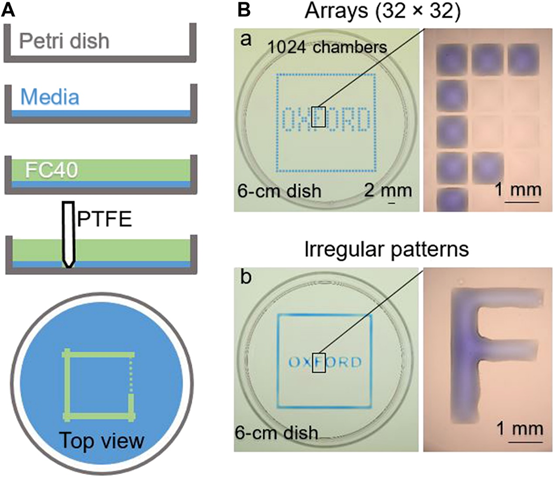
单细胞克隆是从单个祖细胞获得纯克隆的关键步骤,并涉及多种应用,包括细胞和基因治疗领域。随着基因组编辑技术的进步,它有很大的潜力获得对遗传疾病潜在分子机制的有力见解,使用户在该领域进一步发展。IotaSciences所开发的GRIDTechnology克隆平台解决了传统单细胞克隆工作流程中的关键瓶颈。该平台利用了一种新型的细胞培养形式-网格。通过microjet技术从不混溶的液体中切割出单独的腔室,使用FC40的流体微射流重塑细胞介质的薄膜,以在6厘米的皿上创建256个室的阵列。该方法利用界面张力,在整个工作流程中,通过FC40(一种不混溶的碳氟化合物)将反应室分开。每个细胞培养室是1.8毫米x1.8毫米的面积,且每个腔室的工作容积<1微升。

https://doi.org/10.1073/pnas.180544911
细胞以亚微升的体积被自动分配到各个栅格室中,并在其中培养。样品室的小尺寸和光学透明度允许在平板后直接使用isoHub进行高度可靠的单个细胞克隆性的室内验证。通过标准显微镜(4x物镜)可以清楚地看到网格室中的单细胞。这使得能够在分配后立即容易地验证单克隆性。IotaSciencescloningplatform可以用在CRISPR/Cas,,基因编辑,iPSCs,干细胞、蛋白药物研发,细胞株开发等研究。
2023年2月6日,IotaSciences宣布其新建的单细胞挑选器仪器isoPick™的产品开发完成。isoPick™是对IotaSciences现有单细胞处理解决方案产品组合的有力补充,该产品组合基于其专有的流体成形技术。产品组合包括用于自动分离、喂养和收获细胞的仪器(isoCell™)以及单克隆性的验证和记录以及分别衍生的细胞克隆(isoHub™)的跟踪。新的isoPick™仪器通过高度直观和用户友好的触摸屏界面引导的简单工作流程,确保在分离和挑选过程中对单细胞进行温度控制的超温和处理。
IotaSciences的首席商务官AlexanderFeuerborn评论说:“我们对isoPick™仪器的可用性感到非常兴奋,以扩展我们现有的单细胞处理解决方案组合。这应该有助于进一步推动iotaSciences解决方案在欧洲、美国和亚洲客户实验室中不断增长的安装基础。”
3,AxionBioSystems

一句话亮点:基于MEA微阵列的无标记单细胞实时电生理监测
AxionBioSystems于成立于2007年,总部位于佐治亚州亚特兰大,是采用微电极阵列(MEA)和阻抗技术进行活细胞无标记生物分析的开拓者。其开发了全球第一台商品化的高通量细胞生理监测MEA系统-Maestro™,这是一种易于使用的多孔微电极非侵入式仪器,通过体外分析来研究心脏、大脑等细胞的功能,使生物医学研究人员能够改善他们的研究,以进行药物发现和疾病建模。

微电极阵列(MEA)技术是Maestro的核心。Axion采用微电子领域中以及MEMS应用中使用的技术,为客户创建细胞培养MEA微孔板。每个MEA板孔底部紧密嵌合了呈网格状的电极阵列,每个孔都有8到64个电极与这些电活性细胞连接以获取它们的信号。例如,心肌细胞发出的信号类似于人们可能在医院看到的心电图(ECG)信号。每个电极的直径在30到80微米之间,具体取决于应用。改变电极的大小对信噪比起着很大的作用。
科学家们可以在电极上贴附培养神经元/心肌等可兴奋性细胞,它们会逐渐成熟并形成网络,并最终生成网络功能。这样MEA板上每个电极就都可以捕捉到毫秒级的神经元自发放电或心肌细胞的自发搏动,在时间和空间两个维度提供精准的实验数据。AxionBioSystems通过在MEA板的每个孔中的高电极计数阵列上培养细胞网络,捕捉整个细胞群体的活性,每个孔的数据点要多得多,从而检测到传统分析无法检测到的活性模式。
比如,神经细胞(橙色)经培养覆盖于固定在多孔板底部的电极(灰色)上。MaestroMEA系统检测神经网络的功能,包括电活动、同步性和网络震荡。
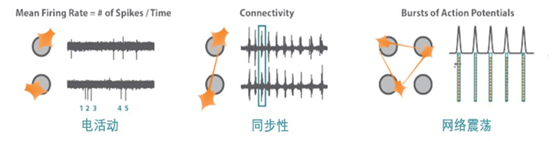
可以通过电活动可以监测动作电位。动作电位发放频率高表明其放电频繁;发放频率低意味着神经元电生理功能可能已受损。同步性用来评判神经元间突触的功能,同步性检测能够反映出突触连接的强弱,及不同的神经元在毫秒级别时间范围内产生同步放电的可能。网络震荡用来评价神经网络的功能性,神经震荡是神经网络的一个重要特征,因为其由兴奋性和抑制性神经元共同影响,即不断变化中的神经活动高潮-低谷周期。
基于细胞的分析能够在体外快速评估生物学功能,与组织或动物模型相比,在产量和成本方面具有显著优势。然而,许多基于细胞的分析是终点分析,仅限于单个时间快照。AxionBioSystems的MaestroPro平台还提供基于阻抗的细胞分析,对细胞进行实时、连续、无标记的监测。连续数据揭示了细胞-细胞相互作用和细胞-药物反应的动力学,有助于更好地理解机理,而无需重复多终点分析的时间和成本密集型过程。
4,Cytena

一句话亮点:皮升级喷墨式单细胞打印机
Cytena公司于2014年成立,孵化于德国Freiburg大学的MEMS应用实验室和Hahn-Schickard研究所,主要提供极具竞争力的单克隆细胞筛选设备。
BICO(前身为CELLINK)是一家总部位于瑞典的公司,专注于生物打印、多组学、细胞开发和制药等应用领域,是生物3D打印领域的领导者。2019年8月,BICO以3025万欧元收购德国生物技术公司Cytena,将后者单细胞3D打印技术收入囊中。
Cellink的首席执行官兼联合创始人ErikGatenholm表示:“我们很高兴通过这次战略收购Cytena。我们正在通过专注于制药行业并为全球研究人员提供最具创新性的解决方案,进一步推动Cellink的全球商业战略。凭借Cytena的革命性技术平台,我们将简化现有和未来客户的工作流程,并加强我们在制药行业的影响力,这一战略与我们的愿景完全一致。与Dispendix和Cytena一起,我们将为全球的学术和制药客户提供全面的解决方案。”
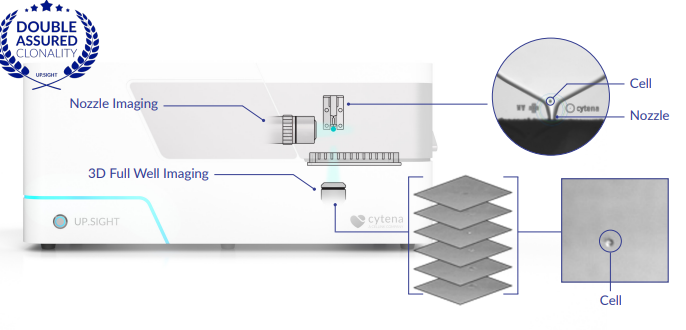
Cytena单细胞打印机因专利的芯片,产生的液滴只有pL级别,是目前世界上分选单细胞的顶尖技术,单细胞分选效率高,极大提高单克隆细胞株的筛选效率。
单细胞生物打印技术的工作原理与喷墨技术类似。系统从微流控芯片中产生微型、自由飞行的液滴。在芯片内(点胶盒的一部分),所有的样品细胞都被储存起来。系统作为直接位移分配器工作,这意味着可以根据需求生成液滴。一个显微镜物镜和一个摄像头用于观察芯片,直接观察细胞。在喷嘴或芯片的下半部分拍摄细胞的图像,并从那里喷射液滴。
一旦捕捉到图像,图像处理算法就会立即检测所有细胞。它对细胞进行计数,并根据形态进行分类,包括大小和圆度。然后生成一个液滴,喷嘴内的所有东西都会在这个液滴中喷射出来。该系统并不能控制液滴的一致性,但它能识别出液滴所包含的内容。然后,这些数据被用来分离具有单细胞的液滴。
为了对液滴进行分类,使用位于喷嘴正下方的气动快门系统。当一个含有单细胞的液滴生成时,它被允许传递到基质上。所有空的和多细胞的液滴都被快门捕获并处理掉。

2020年8月,CytenaGmbH开始与阿斯利康合作,开发新一代基于平板的微型生物反应器,以提高细胞系开发工作流程的效率。专注于开发和商业化创新单细胞分离和培养技术的Cytena表示,与阿斯利康的合作还将探索用于增强单细胞克隆的机器学习算法。
此次合作利用了Cytena在单细胞分离和生物处理领域的最新技术进步,以提高治疗性抗体的发现和生产效率,缩短时间。
5,Lumicks

一句话亮点:单分子及单细胞可视化光镊操控
LUMICKS成立于2014年,总部位于荷兰的阿姆斯特丹,是动态单分子和细胞亲和力分析仪器的领先供应商。

C-trap光镊-共聚焦联用系统
LUMICKS公司的荧光光镊系统C-Trap是世界上第一个允许同时操作和实时可视化单分子相互作用的仪器。它将高分辨率光镊、共聚焦显微镜(或STED超分辨显微镜)以及先进的微流体系统结合在一个真正集成和相关的解决方案中,用于对生物大分子进行操控,研究亚细胞结构,细胞器的力学特性、操控蛋白液滴,研究细胞相分离,将荧光信号和力学信号同时采集,可用于蛋白质与DNA相互作用以及对蛋白构象变化的研究。
LUMICKS的荧光光镊系统主要由以下几个部分组成:(1)光阱操纵系统:用于单分子操纵。(2)微流控系统:为单分子操控系统提供超稳定的液流保障。根据层流原理设计的5个独立进样通道,避免反应物之间的交叉污染,通过软件设定自动加样。(3)力学测量系统:样品所受力的大小通过超灵敏的位置探测器检测,可以达到亚pN的分辨率。(4)可视化系统:共聚焦图像采集,APD检测器,可做单分子成像。
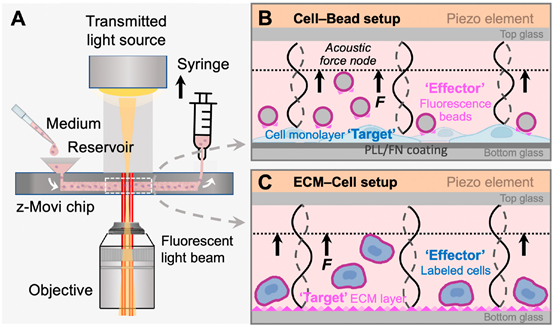
z-Movi细胞亲和力分析仪是一种独特的仪器,可测量免疫细胞与其目标之间的亲和力,能够识别最有效的免疫治疗效应细胞,加速免疫治疗策略的开发。这项新技术提供预测性的、可重复的、快速的单细胞分辨率结果,而不影响细胞活力。
z-Movi工作原理。(A)z-Movi利用压电嵌入式微流控芯片进行细胞亲合力测量。细胞培养基中的靶标和效应器将被注入储液器中,然后通过拉动连接到芯片出口的注射器冲洗到流动室中。成像平台的光路将通过物镜同时获取透射光和荧光。首先冲洗靶细胞或细胞外基质(ECM)蛋白,然后在流动室中孵育以形成单层。为了形成单层细胞,芯片预涂有纤连蛋白或聚L-赖氨酸,可促进细胞附着。否则,流动室底面通过物理吸收涂有ECM蛋白质。(B)Cell-bead设置。在用单层靶细胞涂覆流动室底部玻璃后,将涂有纤连蛋白的荧光bead作为效应物冲入并与单层孵育以形成相互作用。然后,由软件驱动的压电元件在流动室中产生声驻波,并将提升力施加到效应器到声力节点(虚线)。(C)ECM–细胞设置。在Cell-Bead布局中替换荧光Bead,标记的效应细胞被冲入流动室并与ECM蛋白质单层形成相互作用。
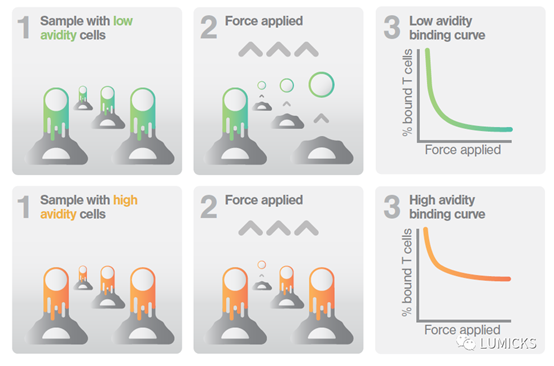
LUMICKS研发的 z-Movi 复合亲合力分析仪开创性地通过声波力测量细胞间的总作用力。测量中,将癌细胞平铺在芯片上,之后流入免疫细胞,待免疫细胞与癌细胞结合后,对免疫细胞施加声波力。随着力的增加,结合弱的免疫细胞会快速地从癌细胞上脱离,而结合强的免疫细胞则会需要更大的力才能脱离。通过这样的方式,研究人员可以快速、准确、方便地比较不同设计的免疫细胞的结合效力,对细胞功效排名,从而提高细胞疗法研发的效率。
6,Cytotronics

一句话亮点:下一代CMOS驱动的药物发现平台
CytoTronics成立于2020年,总部位于美国的Boston,致力于构建下一代互补金属氧化物半导体(CMOS)驱动的药物发现平台,其原理同AxionBioSystems类似,结合来自细胞培养物的细胞动力学、屏障功能、代谢状态、电生理学测量和操作,可被用来测量细胞随时间推移的生长汇合;创建定制的伤口愈合检测共培养模型;评估细胞间连接的完整性;可视化细胞的代谢状态,研究氧化应激、抗氧化能力或细胞死亡机制;测量和刺激心肌细胞或神经元等可兴奋细胞的电信号。
其具体原理是通过将消费级CMOS芯片直接放入细胞培养微孔板的每个孔中,然后对细胞培养物的新型体外筛选进行实时、活细胞电化学成像。筛选前所未有的生物学参数,为产生独特的药物发现渠道开辟了机会。量化与疾病直接相关的形态学参数,如粘附和附着、测量代谢状态、用于癌症应用的凋亡/坏死以及用于心血管或神经疾病的电参数。

上图是封装有CMOS激活的PtB电极阵列与培养神经元的微流体孔(左)封装在一起。其CMOSIC(右)在其中心包含一个64×64像素焊盘阵列(20μm间距)。在每个焊盘上都构建了涂有PtB的Pt电极。b,在示例CNEI设备的电极阵列顶部培养的神经元的假彩色扫描电子显微镜图像。实际记录实验是在包含覆盖整个电极阵列的三到六个细胞层的高得多的神经元密度下进行的。c-e,PtB沉积后Pt电极的三种不同结构的扫描电子显微镜图像(顶视图),所有这些都已被证明可以进入细胞内:PtB涂层的垂直Pt纳米针(c;PtB涂层前的尺寸:9Pt每个焊盘的垂直纳米针间距为3μm,直径约为100nm,高度为1μm);具有PtB涂层的Pt垫边缘电极的PtB涂层垂直Pt纳米针(d;PtB涂层前Pt垫边缘电极的尺寸:沿每个垫边缘约10μm长的脊,高达1μm的高度);和涂有PtB的Pt平面孔电极(e;每个Pt孔都有一个直径为2μm的开口,深度为1.2μm,当PtB电沉积到孔中时,会形成一个微米级的PtB堆)。由于d中的电极结构被证明对高度平行的细胞内记录最有效,因此手稿和补充图中提供的大部分数据都使用这种电极结构。与垂直纳米针相比,e的孔结构采用大大简化的工艺制造,因此一旦进一步优化,在未来可能成为一种有吸引力的替代方案。
CytoTronics平台提供集成的单细胞分辨率电化学成像阵列,是基于在哈佛大学约翰·A·保尔森工程与应用科学学院教授GordonMcKay和HongkunPark博士的实验室研究成果,通过十年的研究和概念验证,根据哈佛技术开发办公室协调的协议,这套专利技术已独家授权给CytoTronics,以实现其商业开发。
CytoTronics的创始团队认识到它有可能彻底改变各个治疗领域的药物发现。现代药物发现依赖于筛选有效化合物以结合已知细胞靶标,这通常是一个昂贵且耗时的过程。CMOS技术以前通过设备小型化彻底改变了消费电子行业,现在CytoTronics正在利用相同的CMOS技术来测量和操作活细胞,并利用先进的CMOS电子器件实现了单细胞空间分辨率,大大提高了测量细胞生物学信息的准确性,并实现了生长细胞的无光学图像。此外,电路集成有助于将这些技术封装到小型、即插即用的设备中,以用于药物发现应用的负担得起的大规模研究。
“我们的目标是通过CytoTronics平台实现价值约200亿美元的低通量细胞检测市场,并计划快速推进到更高的通量——简而言之,使药物发现研究更加精确、自动化、可重复和可扩展,”JeffreyAbbott-CytoTronics的联合创始人兼首席执行官说道。“这笔种子资金使我们能够将我们的研究展示设备商业化,并朝着成为现在光学主导的基于细胞的药物筛选全球市场中独特的电子产品参与者的方向发展。”
但是目前为止还没有CytoTronics平台和药企大规模合作的事件,有待观察后续的发展。
7,Mekonos

一句话亮点:下一代纳米针大分子核酸递送技术
Mekonos成立于2017年,总部位于SanFrancisco。Mekonos将数字微流体与纳米工程MEMS耦合到单个集成芯片上,实现了单细胞精度的基因组编辑分子的可变有效载荷传输,为下一代细胞和基因疗法带来急需的大分子递送技术。
Mekonos应用先进的半导体工艺开发独特的硅纳米针芯片,以增强分子货物进入细胞的传输。MEMS技术用于控制单个纳米针,以实现大规模精确的单细胞输送。Mekonos使用专有的表面化学将货物(DNA、RNA或蛋白质)装载到固体硅纳米针上。通过操纵表面化学动力学,可以控制有效载荷向靶细胞的释放,使细胞工程中的剂量控制达到新的水平。微流体被用来在平台上流动细胞,以及在特定的位置捕获单个细胞。每个细胞捕获位点都与一根针对齐——“一根针,一个细胞”——以便在整个芯片上进行仔细控制、一致的输送,确保每个细胞递送相同数量的核酸分子,并产生高度同质的修饰细胞群体。
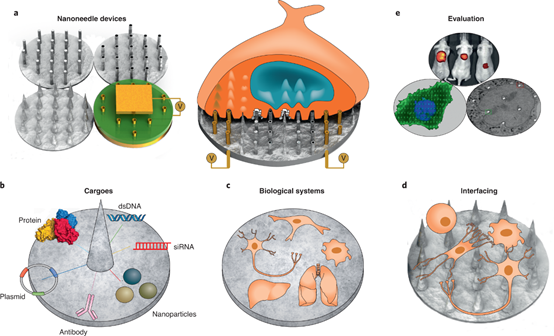
NatureProtocols volume 16, pages4539–4563(2021)
与病毒载体和电穿孔等传统递送技术相比,Mekonos基于纳米针的递送平台在分子有效载荷递送方面实现了前所未有的可行性、效率和一致性。这种纳米针的“戳入递送”可以被细胞很好地耐受,在工程细胞中通常能够实现90-95%以上的存活率,包括初级免疫细胞和干细胞等脆弱细胞类型。这种高生存力(没有恢复期)也使得有效载荷能够顺序输送到工程细胞中,而且即使在具有挑战性的细胞类型中也能实现高效递送。
Mekonos的平台能够将多种不同的货物装载到一个针头上,允许将多种成分同时输送到受体细胞中。这种网内复用支持高级基因编辑和其他多有效载荷应用。在分子量上,Mekonos有能力将超过100kb的大DNA分子通过有效载荷的物理运输直接送入靶细胞。
Mekonos的系统可以通过专有的表面化学(控制从我们的针装载和释放货物)以及针输送过程中的时间控制,精确控制进入每个单元的货物量。这些能力在工程细胞时实现了前所未有的剂量控制,并为细胞治疗开发提供了传统给药无法实现的关键精确度。通过空间和化学控制,我们能够将货物递送特异性地靶向细胞核,从而实现更高效的基因组编辑,并避免细胞质中DNA有效载荷引发的细胞毒性问题。
2021年12月,Mekonos宣布与Neochromosome建立新的合作伙伴关系,Neochromosome专注于创建基因组规模的细胞工程解决方案。新合作的重点是利用尖端合成生物学技术开发新功能,为个性化医疗生产先进的细胞和基因疗法。
作为合作伙伴关系的一部分,Mekonos和Neochromosome将使用Mekonos专有的Iris技术测试和优化Neochromosome 从头合成的“大DNA”货物直接进入人类诱导多能干细胞(hiPSC)细胞核的过程。
“Mekonos独特的基于硅芯片的交付平台与Neochromosome领先的基因组规模工程技术相结合,将使hiPSC工程的精度和效率达到新的水平,”Mekonos业务开发副总裁JakeLesnik说。“我们很高兴能与Neochromosome的世界级团队合作——合成染色体设计和合成的领导者——并利用Mekonos的Iris技术以前所未有的规模和效率离体递送其新颖的大型DNA有效载荷。”
“用于哺乳动物基因组编写的DNA的设计和大规模合成对于哺乳动物基因组的研究和强大的新疗法的创造具有巨大的潜力。有效递送和整合更长的DNA有效载荷,特别是进入干细胞,将是一个实现这些进步的关键一步”,Neochromosome的联合创始人兼首席执行官LeslieMitchell评论道。“这种新的合作伙伴关系代表了一个很好的机会,可以通过结合使用Neochromosome的专有设计器Big-DNA技术和Mekonos交付平台来推进hiPSC的基因组规模工程。我们乐观地认为,这种合作将有助于为细胞疗法的开发创造新的机会,并最终使一系列疾病领域的患者受益。”
8,NAVANTechnologies

一句话亮点:下一代纳米针大分子核酸递送技术
NAVANTechnologies成立于2016年,总部位于South SanFrancisco,和Mekonos一样也是开发基于纳米针的大分子核酸递送技术。
NAVANTechnologies的技术来源于Navan的联合创始人,斯坦福大学材料科学与工程副教授NicholasMelosh,他在2012年的NanoLetter上就发表了相关技术。

NanoStraw技术是一种多功能的平台技术,它建立了与细胞的直接物理连接,以克服全球细胞/基因治疗和再生医学公司面临的巨大挑战,其以温和、无干扰的方式将材料输送到难以转染的细胞中。通过纳米管道运送货物大大减少了细胞治疗制造中的工作步骤、成本、技术困难和细胞死亡。通过克服困扰传统的基于病毒和基于电穿孔的开发的可行性和制造挑战,NAVAN正在与战略合作伙伴一起在广泛的适应症中积极创新疗法。
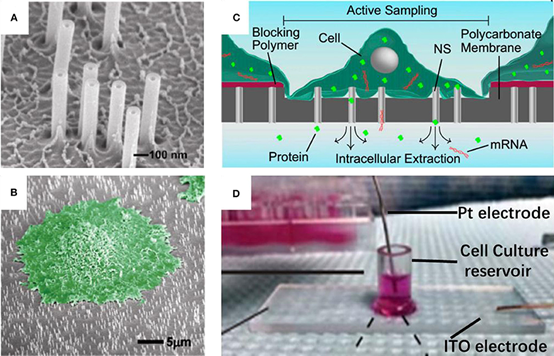
将化学物质运输穿过细胞膜并进入细胞本身的想法并不新鲜,但科学家们迄今为止所依赖的方法存在许多问题。直到2012年,当时Melosh和同事想出了一种让分子进入细胞的新方法。他们会使用电穿孔,但使用纳米吸管以更精确的方式进行,因为纳米吸管相对较长、较窄,有助于将电流集中到非常小的空间中。当时,他们在纳米吸管床上的动物细胞上测试了这项技术。当他们打开电流时,纳米吸管会在细胞膜上打开微小的、大小规则的孔——足以让分子进入,但不足以造成严重损害。
电流还有另一个用途。电流不是等待分子随机漂浮通过新打开的孔,而是将分子直接吸入细胞,从而提高了过程的速度和精度。当时的问题是这项技术是否对临床医生需要操纵的人类细胞种类有效。Melosh和团队表明答案是肯定的——他们成功地将分子递送到三种人类细胞类型和小鼠脑细胞中,所有这些细胞在过去都被证明很难处理。
更重要的是,该方法比其他方法更精确、更快速、更安全。与某些方法需要几天时间相比,纳米吸管技术仅需20秒即可将分子递送至细胞,并且杀死的细胞不到10%,这是对标准电穿孔技术的巨大改进。
Melosh和他的实验室现在正致力于在一些最难处理周围细胞的人体免疫细胞中测试纳米吸管方法。如果他们成功了,这不仅对于想要为研究目的修改细胞的科学家而言,而且对于希望通过免疫疗法治疗癌症的医生来说都是一大步,目前免疫疗法涉及使用病毒方法修改人体的免疫细胞。Melosh说,Nanostraws不仅可以避免这种危险,还可以加快免疫治疗过程并降低成本。
但目前也没有查到和药企的实际合作业务。
9,ScribeBioscience

一句话亮点:皮升级液滴微流控单细胞打印机
ScribeBiosciences成立于2014年,总部位于SanFrancisco。Scribe的技术是根据UCSF大学开发的知识产权建立的,用于构建具有精确细胞比率的微滴微流控分析。单细胞生物学要求能够构建单细胞精度、大量和极少量流体的实验。为了满足这一需求,Scribe开发了一种新技术,即打印液滴微流控技术,该技术将试剂和单细胞封装在皮升液滴中,然后主动选择所需的液滴,并以阵列形式沉积在印刷基板上。这项技术使得大量相关单细胞和多细胞实验的构建成为可能,并使得新的检测方法成为可能。
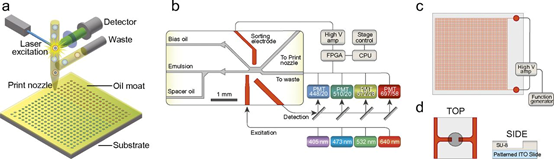
系统的组成部分。(A)液滴在载体油中从喷嘴流出,到达基底上的纳米孔特征,在那里它们被固定。(B)打印头由配有光纤的介电泳液滴分类器组成。四色激发和检测对打印喷嘴感兴趣的液滴进行分类,而所有其他液滴流入废液中。液滴印刷可以使用芯片上的液滴制造或预先形成的乳液的再注入。(C)印刷基板由制造在介电泳陷阱网格顶部的纳米孔阵列组成。这项工作中典型的纳米井直径为150微米,深度为75微米,间距为400微米。(D)在激光蚀刻的ITO涂覆的玻璃载玻片上,从SU8对孔进行光图案化。
已经开发了几种技术来控制和灵活地操纵微流体液滴。数字微流体使用电润湿在专用基板上移动、合并和拆分纳升级液滴,并已用于制备用于测序的样品和探测单细胞水平的细胞间信号。许多方法使用开放式微流体装置将纳升体积分配到基板。尽管这些技术能够以阵列形式实现液滴微流体,但缺乏操纵单细胞和快速切换试剂的能力。
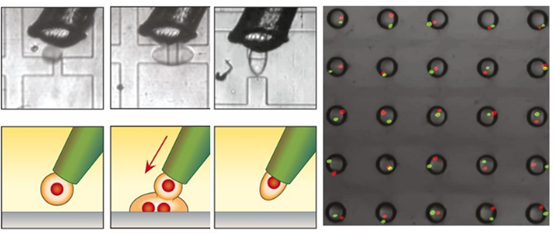
每孔都印有单个calceingreen和calceinred染色PC3细胞。
Scribe开发了新的单细胞操控技术-打印液滴微流控(PDM)。PDM是一种将含有试剂和细胞的微滴印刷到定义的阵列中的微流体,在那里它们可以确定性地组合和操纵。该方法的核心是一个荧光激活液滴分类器,作为一个智能细胞和液滴分配器,与电动平台相连。候选液滴循环通过仪器并被扫描以确定其内容,然后如果液滴包含阵列中给定位置所需的试剂或细胞,则将其打印到基底上。通过这种方式,通过智能分类使液滴印刷具有确定性,允许构建空前复杂的细胞和试剂阵列。PDM结合了微孔板中微升移液的控制和通用性、FACS的精确单细胞分配以及微滴微流体的可扩展性和单细胞灵敏度。
为了将微流体分类器实现为液滴打印机,Scribe克服了几个技术挑战。首先,液滴分选需要油作为载体相,油必须被转移以使液滴到达基底。为了克服会减缓或阻止液滴沉积的粘滞力和浮力,需要一个反作用力将液滴拉到打印位置。一种简单而通用的技术是介电泳,通常用于拉动油中的导电液滴进行高速分选。为了实现介电泳捕获,Scribe在电介质薄片下构建了由双极电极阵列组成的衬底。当通电时,电极发射出在衬底上方延伸的电场,使得液滴沉积到在介电泳陷阱顶部形成图案的纳米阱中,在那里液滴被固定。
液滴微流体的一个持续挑战是很难将许多试剂添加到预先存在的液滴中。目前的方法,如聚结和皮注射,对有限数量的添加有效,不太适合需要在不同时间添加试剂的多种工作流程。在PDM中,可以通过将鼠标悬停在打印位置上并分配额外的液滴来完成添加。每个分配的液滴都被拉到陷阱的最小值,在那里它立即与已经定位在那里的液滴电聚结。PDM可以轻松地执行确定性和可编程的试剂添加到预先存在的液滴中,这使得执行一系列操作成为可能,这些操作太不切实际,无法通过流动的液滴微流体可靠地执行。
液滴分配和添加是生成具有定义组成的阵列的基本操作。通常,实验的下一步是对阵列成像,并且在某些情况下,回收选定的液滴以供进一步研究,例如额外的培养或测序轮次。即使在电场打开的情况下,也可以通过简单地将液滴从基板上抽真空来实现恢复。
10,Thinkcyte

一句话亮点:基于机器视觉图像识别的细胞分选技术
ThinkCyte成立于2016年,总部位于日本东京,是一家采用多学科综合技术进行新药研发的公司。自第一个荧光激活细胞分选系统(FACS)问世半个世纪以来,研究人员仍然没有基于图像信息高速分选单个细胞的商业工具.ThinkCyte公司利用其基于AI进行高通量细胞图像分选的技术GhostCytometry,专注于药物发现、细胞治疗和诊断平台的研发。
ThinkCyte的技术来源于日本东京大学副教授SadaoOta于2018年发表在《Science》杂志的文章。
论文的通讯作者、东京大学的副教授SadaoOta说:“GhostCytometry将对那些需要在实验室中分类细胞的研究人员大有帮助,并将让那些需要快速、准确地分离和诊断细胞样品的临床医生和患者受益。”在论文中,研究人员证实GhostCytometry至少能够分选两种大小和形状相似的细胞,且错误鉴定的细胞非常少。这种设备能以每秒1万个细胞的速率鉴定细胞,并以每秒几千个细胞的速率分选细胞。现有的细胞分选设备无法区分外形相似的细胞,而专家利用显微镜来分选细胞的效率非常低。
ThinkCyte公司的GhostCytometry技术采用专有的先进光学、微流体和人工智能机器学习的组合,利用基于图像的信息实现高通量的单细胞分析和分类。这是一种专有的基于机器视觉的细胞分选(ViCS)技术,将新型超快成像技术与人工智能(AI)相结合,以创纪录的高通量根据图像信息识别和分选细胞速率——甚至超过每秒3,000个细胞。与传统FACS中使用的单一聚光灯相比,ViCS涉及从细胞相对于静态图案化光学结构的运动中获取细胞图像信息,从而将其压缩转换为时间波形。公司开发了基于标记波形的机器学习模型,该机器学习模型通过细胞的波形来预测生物标记物。这种机器学习方法能够以极高的效率进行无需耗时的图像重建——可以实现实时的“无图像”视觉细胞分选。
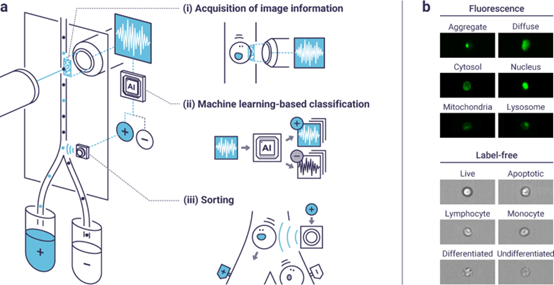
基于机器视觉的细胞分选(ViCS)技术概述。(a)ViCS示意图。(i)当细胞通过投射到微通道上的光照模式时,每个细胞的图像信息首先被压缩转换为时间波形。然后使用单像素检测器记录该波形。(ii)将经过训练的AI模型直接应用于波形以预测细胞类型。(iii)基于机器预测分类的细胞被流体压力轻轻隔离。(b)ViCS可以在荧光和无标记模式下区分的表型示例。所有图像均由AmnisFlowSight拍摄。
GhostCytometry技术平台被应用于各种研究、治疗和诊断,如从未标记细胞群中识别和提取具有较高治疗价值的细胞,用于细胞治疗中的细胞生产,或在临床诊断中从血液中检测异常的癌变细胞。该技术能够使用来自没有物理标记的细胞图像信息来区分不同的细胞状态、细胞类型和细胞质量包括细胞周期阶段、糖酵解水平和凋亡状态。
传统上,在细胞治疗生产过程中,表面标记或染色是表征和分离靶细胞所必需的。通过应用GhostCytometry,我们使用机器预测的“计算机模拟”标记,以高通量进行无标记表征和细胞分离。我们的技术可以根据形态学差异对细胞进行分类和分离,并已用于识别活细胞和死细胞、活化和静止的T细胞以及分化和未分化的干细胞。它还被用于评估细胞和细胞器中更细微的形态学变化,包括细胞周期阶段、糖酵解水平和凋亡状态。该技术与自动化制造过程高度兼容,并且由于无标记细胞表征消除了取样步骤,因此它能够在细胞制造过程中进行在线测量和富集。
这种高通量的基于视觉的细胞分类和分离具有广泛的潜在应用,从细胞治疗和再生医学到药物发现和诊断。ThinkCyte已经与多家领先的全球制药公司和研究机构合作,在生命科学和医疗领域利用ViCS。ThinkCyte正在寻找有兴趣使用其平台进行合作研究的新合作伙伴,以发现新的高价值治疗细胞、新的功能基因和新的候选药物,并/或合作开发仪器,以定制其细胞分析和分选系统,以适应合作伙伴的细胞制造流程。ThinkCyte的联合创始人兼首席执行官WaichiroKatsuda表示:“我们独特的ViCS是一种高通量和高含量的细胞分选系统,有可能彻底改变细胞疗法和药物发现,使全球的患者及其家人受益。“我们相信,我们独特的创新技术将解决生物制药行业的关键问题,并期待建立新的合作伙伴关系,共同创造一个更美好的世界。”
11,Deepcell

一句话亮点:基于机器视觉图像识别的细胞分选技术
Deepcell总部位于加州硅谷,于2017年由斯坦福大学教授尤安·阿什利(EuanAshley)、其博士后麦迪逊·马萨利(MaddisonMasaeli)和计算机科学家玛哈尔·萨勒克(MahyarSalek)创建。同Thinkcyte一样,Deepcell也是利用人工智能技术根据细胞形态差异实现高精度、可重复、无偏差的细胞鉴定和分类,同时保持细胞活力。
迄今为止,Deepcell的人工智能分类器已经训练了数千万张多种类型的细胞图像,作为该公司快速增长的细胞形态学图谱的一部分,它能够准确地区分各种免疫细胞亚型、各种癌症细胞和基质细胞。
该系统的基本原理是一个专有的微流体台式仪器,它允许在线细胞成像,以监督和非监督分类和排序,目前已发展为存有10亿细胞图像信息的数据库,基于如此庞大的数据集,研究人员可以在不同的层面进行深度挖掘。
这种基于人工智能的细胞识别技术,大大优于基于细胞表面标记的技术,因为后者存在可用标记物和检测通道数量的限制性,同时,选择表面蛋白需要丰富的生物学知识,以及蛋白质特异性抗体的可用性。虽说现在已经开发出了几种微流控细胞分选技术,可以在不依赖分子表面标记的情况下分离细胞,但这些方法仍然依赖于预定的形态学特征,如细胞大小、变形性或其它可观察到的表型特征。
除此之外,该公司也表示,通过Deepcell平台分类的细胞仍然具有活力,可以用于任何下游的分析,产生的结果不受干扰,甚至可以对这些分离出的细胞进行体外培养。同时,该技术也非常适合单细胞多组学分析,从而实现细胞形态定性与多组学方法的集成,以达到对细胞生物学前所未有的深度认识。也就是说,这种人工智能技术可以基于形态学特征分离和捕获几乎任何细胞群体,它可以用于各种研究和应用开发。这项技术的普及会将细胞形态带入数字时代,就像高性能计算使基因组学和转录组学取得巨大进步一样,而Deepcell显然已跻身该领域的前列。
Deepcell的首席技术官MahyarSalek表示:“Deepcell的数据表明,深度学习可以实现较高的分类准确率,揭示了精确描述细胞特征和表型的新方法,并能够对感兴趣的细胞进行无标记分离,以进行进一步的深度分析。这项技术为生物医学界的科学家、转化研究机构和制药行业提供了一种新的工具,以从细胞形态学数据中获得对细胞的深度认识。”
据该公司介绍,该技术可以分离发生频率低至10亿分之一的细胞,其潜在应用领域包括单细胞基因组学、液体活检、产前诊断、特定疾病状态下细胞和分子相互作用的表征以及药物开发等。
Deepcell首席执行官兼联合创始人MaddisonMasaeli在一份声明中表示:“得益于我们在人工智能、微流体和多组学方面的创新,Deepcell通过增加规模、可解释性和可操作性,将这种表型带入现代应用中。”
在商业化层面,该公司目前的合作伙伴包括黑色素瘤等领域的临床研究人员,在这些领域,肿瘤细胞无法表达正确的表面标记,因此,传统的细胞分离工具无法有效工作。此外,该平台能够区分特定肿瘤类型的形态学模式,追踪癌细胞在体内的起源,同时根据细胞的外观推测细胞是否存在功能获得或功能缺失突变,所以说未来亦可以癌症诊断和分类。
12,LevitasBio

一句话亮点:基于无标记磁悬浮芯片的无损细胞分离技术
LevitasBio成立于2017年,总部位于门洛帕克,以无标记磁悬浮芯片技术重新定义细胞处理,通过提供一种无标记、简便且温和的分离特定细胞群的颠覆性技术方法,以克服当前细胞处理的技术缺陷。此前,它与塞力医疗达成合作,双方于2021年5月在国内成立合资公司力微拓,合资公司获得了3项核心专利及生产工艺的大中华区独家授权。
此前,大型仪器中的磁悬浮已用于测量中尺度粒子的密度和组装宏观尺度物体。然而,由于无法监测微型物体,磁悬浮在生命科学中的应用受到了阻碍。

LevitasBio的研究则把磁悬浮技术推向了微型物体。它证明了真核细胞和原核细胞都可以悬浮,并且每个细胞都具有独特的悬浮特性。在许多生理事件期间,如分化、细胞死亡、衰老、免疫反应或耐药性,由于细胞内顺磁性活性氧的形成,进一步的生物变化伴随着细胞磁信号的瞬时变化。不同类型或状态的细胞具有独特的物理特征,当它们遇到磁密度场时,会以可预测的方式漂浮。该技术便是利用细胞因磁悬浮磁力作用进行聚类的特征,在血液、体液及其它液态样品中,快速分离、富集以及捕获不同种类的细胞。
磁悬浮技术是进行细胞分析的新方法。不同类型或状态的细胞具有独特的物理特性,可对磁场强度区域产生反应,从而产生独特的悬浮高度。当与微流控芯片搭配使用时,LeviCell™可利用磁悬浮处理载入的样品,并根据它们各自独特的物理特性进行分析和分离。
对于样品富集,常规方法包括手工操作、离心、磁珠共轭,以及最近的FACS(荧光激活细胞分选)。这些方法被广泛使用已有几十年了,但它们也有其自身的局限性。例如,由于使用了染色、标签或标记,不可避免的让样品遭受极端恶劣的条件,例如高重力、大压力或它们生物学状态的改变。而这些通常会导致细胞凋亡、低细胞活力、低细胞回收率、可变亚群丢失、细胞激活或细胞应激,所有这些都极大地限制了再现本应被研究的(样本)天然生物学的能力。
使用磁悬浮技术分离样品,这是一个根据细胞密度进行区分的轻柔过程,不需要染料、标签、标记物或高压。因此,细胞的天然生物学状态得以保留,以确保基因表达谱和下游分析以及最终结果不受(样本处理的)影响。此外,由于细胞轻轻悬浮在优化的缓冲液中,因此还可对其进行成像和分析,以提供目标样品表征和做出关键下游决策的能力。
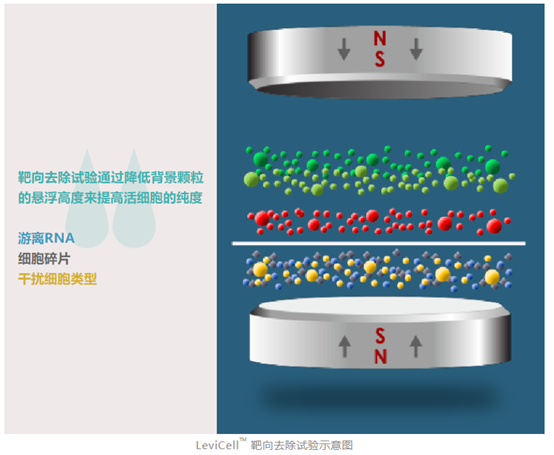
力微拓(上海)生命科学有限公司携全球首创的无标记、液体磁悬浮、微流控细胞分离富集系统LeviCell™首次亮相中国市场。LeviCell™是世界首台可以快速(20分钟左右)、无标记的完成样本细胞分离和富集的仪器。无标记磁悬浮细胞分离技术是目前全球唯一的无标记活细胞分离技术,该技术在活细胞富集、单细胞测序前处理、组织样本处理、肿瘤样本处理等领域有着极其广泛的应用。
结语
单细胞测序领域赛道略显拥挤,同质化严重,缺乏底层创新。在应用端目前还是聚焦在科研层面,限制了单细胞技术的潜力发展。而随着细胞与基因治疗(CGT)的快速发展,虽然CGT本身也需要时间来证明其可带来更多临床受益的增加,但是单细胞操控及表征技术在CGT治疗以及以细胞为主的再生医学产品方面还是具有极大的市场需求价值。这类技术将应用于单细胞克隆筛选、单细胞操控、单细胞分选后培养和单细胞表征等方面,为细胞类临床产品提供细胞纯度,细胞编辑效率,递送药物定量等多维信息表征,在细胞药物研发效率提速以及保证细胞药物安全性方面,将发挥极其重大的作用。
声明:本文系本网站编辑转载,转载目的在于传递更多信息,并不代表本网站赞同其观点和对其真实性负责。如涉及作品内容、版权和其他问题,请在本网站转载后30日内与本网站联系,我们将在第一时间妥善处理。本网站转载文章版权归原作者所有,内容为作者个人观点,本网站仅供参考,并不构成任何投资及应用建议。本网站拥有对此声明的最终解释权。


北京聚创造网络科技有限公司 北京前端和北方决策总部 长沙后端和南方决策总部
ICP证京B2-20171386 京ICP备17032325号 京公网安备 11010802024499号